

遗传性出血性毛细血管扩张症的肝脏钆塞酸二钠增强MRI表现
1.关键词:遗传性出血性毛细血管扩张症;钆塞酸二钠;磁共振;
2.病例简介:患者,女,40岁。
主诉:发现肝功能异常2月,间断腹痛1月余;
现病史:患者2月前因“引产后4月”于当地医院妇科门诊复查,肝功能提示ALT 87U/L,AST 58U/L, ALP 58U/L,GGT 216.2U/L,未重视。1月余前无明显诱因出现右下腹痛,为钝痛,3-5天发作一次,每次持续3-5分钟,可自行缓解,伴轻度头晕、乏力,就诊于当地医院化验提示 ALT 43U/L,AST 43U/L,ALP 145U/L,GGT 270.2U/L,后于我院门诊就诊。
家族史:无
查体:患者双侧脸颊及舌头可见散在毛细血管扩张。
实验室检查:谷丙转氨酶、谷草转氨酶、碱性磷酸酶、谷氨酰转肽酶、间接胆红素、免疫球蛋白M(IgM)升高;抗线粒体抗体M2(AMA-M2)阴性;
影像表现:肝动脉增粗;肝静脉早显;肝脏动脉期花斑样强化;肝内多发局灶性结节增生。
基因检测结果:遗传性出血性毛细血管扩张症2型相关基因ACVRL1存在1处杂合变异。
3、影像学图像
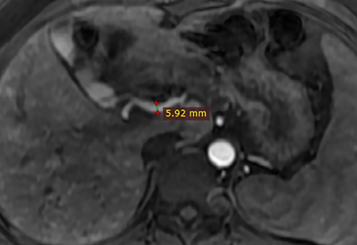
图1 钆塞酸二钠增强MRI动脉期显示肝动脉直径约为5.9mm。
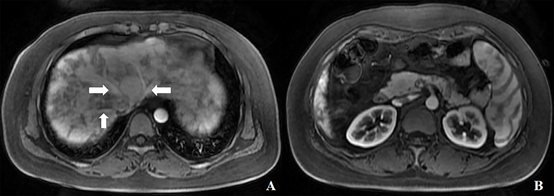
图2 钆塞酸二钠增强MRI动脉期图像。(A)三支肝静脉(箭头)早显;肝实质不均匀强化;(B)低于A图层面,双肾及脾脏强化特征提示该采集期相为动脉期。
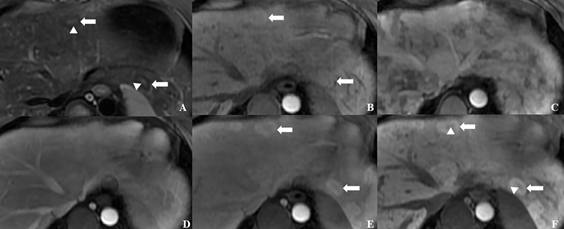
图3 肝内多发结节。结节(长箭头)在T2WI呈稍低信号(A),增强后动脉期明显强化(C),肝胆期高摄取(F);结节中心瘢痕(短箭头)在T2WI呈稍高信号(A),肝胆期上低信号(F)。
A:T2WI压脂序列 B:T1WI增强前蒙片 C:动脉期 D:门脉期 E:过渡期 F:肝胆期。
4. 讨论
遗传性出血性毛细血管扩张症(HHT)是一种常染色体显性遗传的血管发育异常性疾病,以动静脉畸形和毛细血管扩张为特征,常见的受累器官有皮肤、结膜、口、舌、肝及胃肠道等[1-3]。据报道,41–84%的HHT患者可累及肝脏[4]。HHT肝脏受累的影像学特征包括肝动脉增粗,肝静脉早显,肝脏动脉期花斑样强化以及肝内多发局灶性结节增生[5]。
在正常肝脏增强MRI中,三支肝静脉的强化规律为动脉期均无强化,门脉期同时明显强化且达强化峰值。若肝静脉在动脉期出现明显强化,则为肝静脉早显,提示有动静脉瘘的可能。正常肝实质在各期均匀强化,且于门脉期达强化峰值。当肝实质在动脉期出现不均匀强化时,提示可能存在肝血管异常。当HHT肝脏受累时,肝脏出现花斑样强化可能原因有动门脉分流(65%)、毛细血管扩张(63%)、融合性血管团(25%)[6]。
肝总动脉常起自于腹腔干,在肝总动脉发出胃十二指肠动脉前测量管径大小,若直径>4.5mm,则认为肝总动脉增粗[7]。肝局灶性结节增生是肝内常见的良性病变,在T1WI呈等或稍低信号,T2WI上呈等或稍高信号,增强扫描后动脉期明显强化,在肝胆期呈高信号。而中心瘢痕在T2WI上呈高信号,增强扫描后在肝胆期上呈低信号。据报道,在HHT患者中FNH的患病率为2.9%[8],这可能是由于肝内多发血管畸形致肝实质动脉血供增加,进而发生肝细胞反应性增生。
本例患者的肝脏钆塞酸二钠增强MRI上出现了肝静脉早显,肝动脉增粗,肝实质动脉期花斑样强化及肝内多发局灶性结节增生,符合HHT肝脏受累的典型影像学表现。一旦诊断HHT,因出血风险高,患者不能进行肝穿刺活检。HHT肝脏受累时患者通常无明显症状,但部分患者可出现高输出量心衰及继发型门脉高压等严重并发症[5]。因此,影像学检查在诊断及评估HHT患者预后方面发挥着重要作用。只有正确掌握肝脏正常的影像学表现,才能有助于影像科医生发现异常影像表现,作出正确诊断,帮助临床指导患者的治疗。
[1] FAUGHNAN M E, MAGER J J, HETTS S W, et al. Second International Guidelines for the Diagnosis and Management of Hereditary Hemorrhagic Telangiectasia [J]. Annals of internal medicine, 2020, 173(12): 989-1001.
[2] GUTTMACHER A E, MARCHUK D A, WHITE R I, JR. Hereditary hemorrhagic telangiectasia [J]. The New England journal of medicine, 1995, 333(14): 918-24.
[3] KRITHARIS A, AL-SAMKARI H, KUTER D J. Hereditary hemorrhagic telangiectasia: diagnosis and management from the hematologist's perspective [J]. Haematologica, 2018, 103(9): 1433-43.
[4] KHALID S K, GARCIA-TSAO G. Hepatic vascular malformations in hereditary hemorrhagic telangiectasia [J]. Seminars in liver disease, 2008, 28(3): 247-58.
[5] GARCIA-TSAO G. Liver involvement in hereditary hemorrhagic telangiectasia (HHT) [J]. J Hepatol, 2007, 46(3): 499-507.
[6] TORABI M, HOSSEINZADEH K, FEDERLE M P. CT of Nonneoplastic Hepatic Vascular and Perfusion Disorders [J]. Radiographics : a review publication of the Radiological Society of North America, Inc, 2008, 28(7): 1967-82.
[7] WU J S, SALUJA S, GARCIA-TSAO G, et al. Liver involvement in hereditary hemorrhagic telangiectasia: CT and clinical findings do not correlate in symptomatic patients [J]. AJR Am J Roentgenol, 2006, 187(4): W399-405.
[8] BUSCARINI E, DANESINO C, PLAUCHU H, et al. High prevalence of hepatic focal nodular hyperplasia in subjects with hereditary hemorrhagic telangiectasia [J]. Ultrasound in medicine & biology, 2004, 30(9): 1089-97.